| N-T.ru / Текущие публикации / Техника сегодня |
Энергетический баланс процессов синтеза молекул кислорода, водорода и водыВ инженерной практике по обслуживанию вентиляционных систем обнаружено появление избыточной тепловой энергии в циркулирующем воздухе. Аналогичное явление зафиксировано и в системах циркуляции воды с устройствами для её активной кавитации. Результаты наших исследований не только объясняют причину этих явлений, но позволяют делать количественные расчеты энергетических процессов, генерирующих дополнительную тепловую энергию [1]. Атом кислорода – восьмой элемент периодической таблицы химических элементов, расположенный в её шестой группе. Структура его ядра показана на рис. 1 [1].
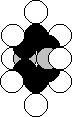
Рис. 1. Схема ядра атома кислорода: светлые – протоны, темные и серые – нейтроны На рис. 2 представлена схема атома кислорода, следующая из структуры его ядра (рис. 1). Он имеет восемь электронов, наиболее активны те из них (1, 2), что расположены на оси симметрии. Шесть других электронов, расположенных в плоскости перпендикулярной осевой линии (линии симметрии), своим суммарным электрическим полем удаляют электроны 1 и 2 от ядра на большее расстояние, формируя условия для большей их активности при взаимодействии с электронами соседних атомов [1].
Рис. 2. Схема атома кислорода Наименьшая энергия ионизации электрона атома кислорода равна Ei = 13,618 эВ, а энергия связи этого электрона с ядром атома, соответствующая первому энергетическому уровню E1 = 13,752 эВ. Назовем этот электрон первым. Расчет энергетических показателей этого электрона, в том числе и энергий связи Eb его с ядром атома, по формулам (1) и (2) даёт следующие результаты (табл. 1) [1].
Таблица 1 Спектр первого электрона атома кислорода, эВ
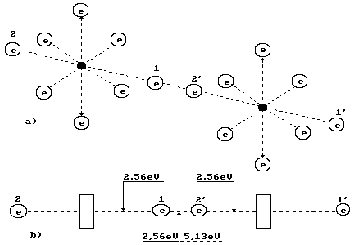
Структура молекулы кислорода, показана на рис. 3а. Она образуется путем соединения разноименных магнитных полюсов осевых электронов двух атомов кислорода [1]. Известно, что процесс синтеза молекул кислорода сопровождается выделением 495 кДж/моль энергии или в расчете на одну молекулу
Каким же принципом руководствуется Природа, распределяя энергию 5,13 эВ между электронами молекулы кислорода (рис. 3а)? Энергия 5,13 эВ – термическая энергия связи между электронами 1 и 2' двух атомов кислорода (рис. 3а). При образовании молекулы кислорода она излучается в виде фотонов электронами, вступающими в связь. Из этого следует, что она равна сумме энергий двух фотонов, излучённых этими электронами. Следовательно, каждый электрон, вступающий в контакт, излучает по фотону с энергиями 5,13/2 = 2,565 эВ (рис. 3б). Согласно табл. 1 валентные электроны в этом случае занимают положения между вторым и третьим энергетическими уровнями [1].
Рис. 3. Схема распределения энергий связи между электронами в молекуле кислорода Два атома кислорода соединяются в молекулу в состоянии возбуждения. Состоянием возбуждения считается такое состояние атома, при котором его валентные электроны удалены от ядер на такие расстояния, когда энергия связи между ними уменьшается до тысячных долей электрон-вольта. В таком состоянии атом может потерять электрон и стать ионом. Или, не теряя электроны, он соединяется валентным электроном с электроном соседнего атома и начинается процесс формирования молекулы кислорода. Это – экзотермический процесс, при котором осевые валентные электроны 1 и 2', излучая фотоны и опускаясь на более низкие энергетические уровни, выделяют 2,565×2 = 5,13 эВ. Обратим внимание на то, что энергия 5,13 эВ выделяется двумя электронами, формирующими связь с энергией 2,56 эВ. В современной химии эта связь называется ковалентной. Для разрушения этой связи достаточно затратить 2,56 эВ механической энергии. Для термического разрыва этой связи энергии требуется в два раза больше, то есть 5,13 эВ. Это объясняется тем, что энергия фотона 5,13 эВ поглощается одновременно двумя электронами. Только в этом случае оба электрона будут переведены на самые высокие энергетические уровни с минимальной энергией связи, при которой они разъединяются, и каждый атом кислорода становится свободным. Таким образом затраты энергии на разрушение молекулы кислорода зависят от способа воздействия на связь. При термическом воздействии на связь она разрушается при энергии 5,13 эВ. При механическом воздействии на связь достаточно затратить 2,56 эВ энергии, чтобы разрушить эту связь. Из этого следует, что энергетика процесса синтеза молекулы кислорода зависит от способа её разрушения. После термического разрушения молекулы кислорода, процесс её формирования начинается с излучения обоими валентными электронами по фотону с энергиями 2,56 эВ и прежняя энергия электродинамической связи (2,56 эВ) между электронами обоих атомов восстанавливается. Таким образом, при термическом разрушении молекулы кислорода тепловой энергии затрачивается столько же, сколько выделяется при последующем её образовании. Никакой дополнительной энергии при термической диссоциации молекулы кислорода и последующем её синтезе не появляется. Если же молекулу кислорода разрушать механическим путем, то для этого достаточно затратить 2,56 эВ механической энергии. При этом валентные электроны атомов кислорода, оказываются в свободном состоянии при недостатке энергии, соответствующей такому состоянию, так как процесс поглощения каждым из них 2,56 эВ энергии отсутствовал. В таком состоянии электроны не могут оставаться, они должны немедленно восполнить энергию, которую они не получили при механическом разрыве связи между ними. Где они её возьмут? Источник один – окружающая среда, то есть физический вакуум, заполненный эфиром. Они немедленно преобразуют эфир в энергию 2,56 эВ. Следующая фаза – соединение двух атомов кислорода, валентные электроны которых пополнили запасы своей энергии за счет эфира. Этот процесс сопровождается излучением двумя электронами фотонов с энергиями 2,56 эВ. Так энергия поглощенного эфира преобразуется в тепловую энергию фотонов. Затратив 2,56 эВ механической энергии на разрушение молекулы кислорода, при последующем синтезе этой молекулы мы получаем энергии в два раза больше (2,56×2 = 5,13) эВ. Дополнительная энергия оказывается равной 2,56 эВ. Существует немало экспериментальных данных показывающих, что в вентиляционных системах тепловая энергия циркулирующего воздуха превосходит электрическую энергию, затраченную на привод вентиляторов. Теперь мы знаем, что эта энергия генерируется при механическом разрушении ковалентных связей в молекулах газов, из которых состоит воздух. Используя изложенную методику, проанализируем энергетику молекулы воды, которая также в ряде случаев генерирует дополнительную энергию. Молекула воды состоит из одного атома кислорода и двух атомов водорода. Энергии связи Eb атомов водорода с его ядром представлены в табл. 2. Таблица 2 Спектр атома водорода, эВ
Известно, что соединение водорода с кислородом происходит в большинстве случаев с взрывом, но причина этого до сих пор не известна. Попытаемся найти её. Энергия синтеза молекулы водорода равна 436 кДж/моль или 4,53 эВ на одну молекулу. Поскольку молекула состоит из двух атомов, то указанная энергия распределяется между ними. Таким образом, энергия одной связи между атомами водорода оказывается равной 2,26 эВ (рис. 4). При механическом разрыве этой достаточно затратить 2,26 эВ. При термическом разрушении этой связи энергии потребуется в два раза больше (2,26×2 = 4,53 эВ).
Рис. 4. Молекула водорода Для образования двух молекул воды необходимо разрушить на атомы две молекулы водорода и одну молекулу кислорода. При механическом разрушении ковалентных связей на разрушение двух молекул водорода затрачивается 2,26×2 = 4,53 эВ, а молекулы кислорода – 2,56 эВ. Сумма этих энергий равна 7,13 эВ. Если процессы разрушения указанных молекул проводить термическим путем, то на разрушение двух молекул водорода потребуется 4,53 + 4,53 = 9,06 эВ, а на разрушение одной молекулы кислорода – 5,13 эВ. В сумме это составит 14,19 эВ. Разница почти двукратная. Известно, что при синтезе одного моля воды выделяется 285,8 кДж или 285,8·1000/6,02·1023·1,6·10–19 = 2,9 эВ на одну молекулу. Так как молекула воды состоит из одного атома кислорода и двух атомов водорода, то на одну связь приходится 2,96/2 = 1,48 эВ (рис. 5). Из этого следует, что электроны атомов водорода и кислорода в молекуле воды находятся при обычной температуре (1,48/2 = 0,74 эВ) между четвертыми и пятыми энергетическими уровнями (табл. 1, 2).
Рис. 5. Схема молекулы воды: 1, 2, 3, 4, 5, 6, 7, 8 – номера электронов атома кислорода; P1, P2 – ядра атомов водорода (протоны); e1 и e2 –электроны атомов водорода Таким образом, на разрушение двух молекул водорода и одной молекулы кислорода термическим путем израсходовано 14,19 эВ, а в результате синтеза двух молекул воды выделится 2,96×2 = 5,98 эВ. В чем причина такого дисбаланса? Ответ прост. При переходе из газообразного в жидкое состояние атом кислорода в молекуле воды, должен уменьшить свой объём. Это произойдет, если кольцевые электроны атома кислорода опустятся на более низкие энергетические уровни (ближе к ядру). При этом они обязательно излучат фотоны, и мы уже знаем их общую энергию. Она равна энергии, затраченной на разрушение двух молекул водорода и одной молекулы кислорода, то есть – 14,19 эВ. Поскольку у двух молекул воды 12 кольцевых электронов, то каждый из них излучит 14,19/12 = 1,18 эВ. Это больше энергии (0,74 эВ) связи с ядром осевых электронов и указывает на то, что кольцевые электроны расположены ближе к ядру, чем осевые. В этом случае количество энергии, полученной в результате синтеза двух молекул воды (14,19 + 5,98) эВ оказывается больше энергии, затраченной на разрушение двух молекул водорода (9,06 эВ) и одной молекулы кислорода (5,13 эВ). Сформировавшаяся разность энергий 5,98 эВ разделится между двумя молекулами воды. На одну молекулу приходится (5,98/2) = 2,99 эВ или 285,8 кДж/моль, что полностью соответствует существующим экспериментальным данным. Изложенное выше проясняет причину взрыва при соединении водорода с кислородом. Одновременный переход шести кольцевых электронов каждого атома кислорода, в рождающихся молекулах воды, на более низкие энергетические уровни сопровождается одновременным излучением фотонов, которые и генерируют энергию взрыва. Обратим внимание, что на рис. 5б показано две энергии связи между валентными электронами e2 и 2, а также между 1 и e1. Электродинамическая связь равна 0,74 эВ. Для разрыва этой связи достаточно затратить такое же количество механической энергии. Если же эту связь облучить фотонами с энергией 0,74 эВ, то процесс поглощения фотонов будет идти так, что каждый из двух валентных электронов поглотит по 0,37 эВ и энергия связи уменьшится до 0,37 эВ, и молекула воды не разрушится. Вторая, тепловая энергия связи, указанная на том же рисунке, равна 1,48 эВ. Если оба электрона поглотят фотон с этой энергией, то энергия связи между ними станет равной нулю и молекула воды разрушится. Из изложенного следует, что если указанные связи разрушать механическим путем, затрачивая по 0,74 эВ на каждую связь, то после её разрыва у каждого электрона образуется дефицит энергии, равный 0,74 эВ. Эта энергия будет немедленно поглощена из окружающей среды и излучена при повторном синтезе молекулы воды. Так ковалентная химическая связь при механическом разрушении одной молекулы воды формирует 1,48 эВ дополнительной тепловой энергии, которая, как мы уже отметили, устойчиво регистрируется в системах кавитации воды. Известно, что молекулы воды, объединяясь, формируют кластеры. Если связи между молекулами в кластерах ковалентные, то механическое разрушение этих связей также должно сопровождаться выделением дополнительной тепловой энергии. На Российском рынке уже три фирмы «Юсмар», «Термовихрь» и «Нотека» продают кавитационное водонагревательное оборудование с показателем энергетической эффективности до 150%. Готовятся к выпуску и воздушные нагревательные приборы с такой же эффективностью. Источником дополнительной энергии, генерируемой этими приборами, являются процессы механического разрушения ковалентных связей молекул газов воздуха, молекул и кластеров воды, и их последующий синтез. ЗаключениеАнализ энергетического баланса молекул с ковалентными связями показывает возможность формирования дополнительной тепловой энергии при механическом разрушении этих связей.
Источник информации: Канарёв Ф.М. Начала физхимии микромира. Краснодар. 2002. 320 с. |
|
Дата публикации: 5 мая 2003 года |
|